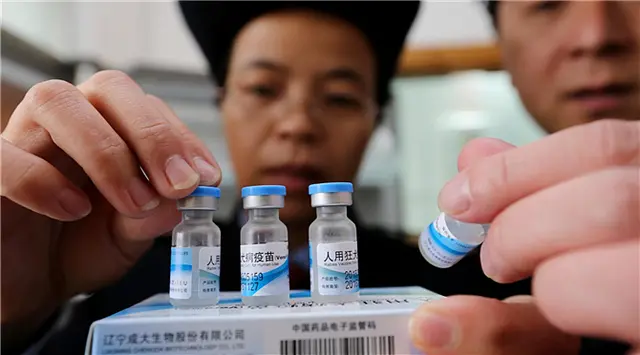
【亞太日報訊】(記者王思北 白陽)國務院日前公佈並施行了《國務院關於修改〈疫苗流通和預防接種管理條例〉的決定》,要求嚴格疫苗監管,規範接種行為,堅決保障疫苗接種安全。專家認為,改革疫苗監管的法律制度,有利於構建更為合理的疫苗安全網絡,保障接種安全。
目前,中國將疫苗分為兩類,第一類疫苗是指政府免費向公民提供,公民應當依照政府的規定受種的疫苗;第二類疫苗是指由公民自費並且自願受種的其他疫苗。
中國醫藥工程設備協會會長顧維軍認為,山東濟南非法經營疫苗系列案件暴露出第二類疫苗流通鏈條過長,處在整個鏈條上各個節點的疫苗批發企業、疾控機構、接種單位層層加價,流通過程牟利空間巨大,鏈條上各相關方參與非法經營疫苗的利益驅動明顯,使得非法疫苗商販很容易獲得“可乘之機”。
為此,條例規定,取消疫苗批發企業經營疫苗的環節,明確將疫苗的採購全部納入省級公共資源交易平臺,第二類疫苗由省級疾病預防控制機構組織在平臺上集中採購,由縣級疾病預防控制機構向疫苗生產企業採購後供應給本行政區域的接種單位。
“由於疫苗對溫度敏感,而且歷經生產、運輸、儲存、接種等多個環節,在任何一個環節,都可能會因溫度過高而失效或減效,需要通過全程冷鏈來保證疫苗品質和效果。”南開大學法學院教授宋華琳說,中國目前客觀上存在冷鏈設施不足、冷鏈技術落後等問題,且缺少有力的監管措施。
為此,條例強化了疫苗全程冷鏈儲運管理制度,明確配送責任,強化儲運的冷鏈管理,要求疫苗儲運全過程不得脫離冷鏈並定時監測記錄溫度,部分疫苗還應加貼溫控標簽,同時在疫苗接收環節增設索要溫度監測記錄的義務。
條例還規定,國家建立疫苗全程追溯制度,相關企業和單位應記錄疫苗流通、使用信息,實現疫苗最小包裝單位的全程可追溯;對包裝無法識別、來源不明等情形的疫苗,要如實登記並向藥品監管部門報告,由監管部門會同衛生主管部門監督銷毀。
“疫苗安全尤其需要實現全程可追溯。”宋華琳表示,建立疫苗全程追溯管理制度,有助於落實企業主體責任,倒逼疫苗生產企業切實改進疫苗品質管理制度,確保疫苗安全有效,一旦發生問題也能及時召回。有助於監管部門對疫苗供應鏈全過程進行有效監管,發生問題時及時查明責任主體,界定事件成因,制定應對方案,落實法律責任。此外,還有助於消費者了解所接種疫苗的品質信息和過程信息,保障消費者的知情權和選擇權。
問題疫苗醜聞
中國在爆出非法經營疫苗醜聞後,已經有202人被捕。
中國發生的非法經營疫苗系列案件涉及數百萬個非法疫苗黑市交易,醜聞爆發後引起公憤,也暴露了中國這個世界第二大藥品市場監管的弱點。
事發後,國務院決定依法對食品藥品監管總局、衛生計生委和山東等17個省(區、市)相關責任人予以問責等處分。
二類疫苗
中國2005年頒布實施《疫苗流通和預防接種管理條例》,將疫苗分為一類疫苗(免費疫苗)和二類疫苗(自費疫苗),其中一類疫苗由省級疾控機構採購並逐級向下分發,流通過程較為規範;二類疫苗則有多種流通方式,接種單位可以自主採購。
而出現問題的疫苗主要為二類疫苗, 因為其諸多的流通環節,很容易受到利益驅使而造成漏洞。
《新京報》引用一位北京中醫藥大學講師的話稱,中國對二類疫苗的監管相對寬鬆,導致二類疫苗生產、倉儲、銷售等方面都存在監管真空。
但該報同時引用北京一家醫藥管理諮詢機構負責人的評論稱,除非疾控(中心)不從中掙錢,加強監管者角色。否則只要涉及利益,怎麼都會出現漏洞。
而問題疫苗醜聞涉及的疫苗價值3.1億元人民幣,其中非法交易達9000萬元。
世界衛生組織稱,中國疫苗生產業和在中國政府的免疫注射計劃下的疫苗都是安全的,但是在私營企業間還略有漏洞。
 简体中文
简体中文