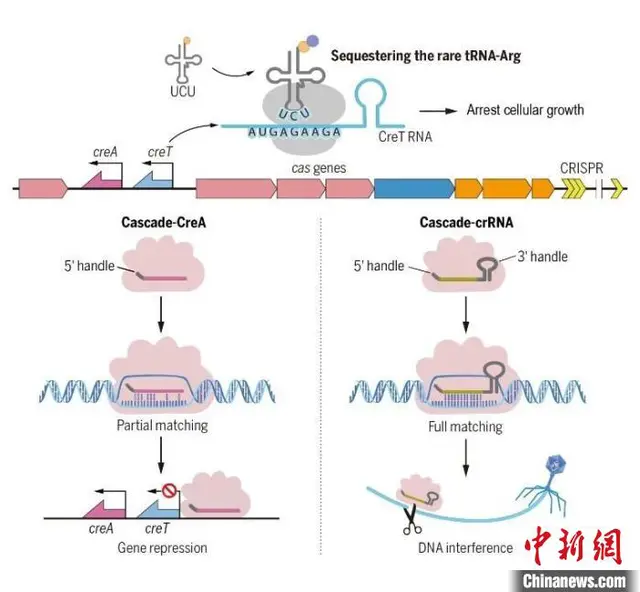
CRISPR-Cas系统与CreTA毒素-抗毒素系统的互作机制。中科院微生物所 供图
中新网北京4月30日电(记者 孙自法)记者从中国科学院微生物研究所(中科院微生物所)获悉,该所研究员向华/李明团队最新从自然界分布最广泛的微生物适应性免疫系统CRISPR-Cas基因簇内部,发现了对CRISPR-Cas具护卫功能的RNA“暗物质”系统。
中国科学家在微生物领域这一重大发现及科研成果论文,4月30日由国际顶级学术期刊《科学》(Science)在线发表。该项研究对基因编辑技术发展、新型药物设计研发等有可能产生深远影响。
CreTA保护Cascade基因簇的遗传稳定性。中科院微生物所 供图
中科院微生物所介绍说,向华团队是中国最早开展CRISPR-Cas生物学研究的团队之一,此前已在CRISPR-Cas抗病毒适应机制领域取得系统性成果。近期,向华团队与李明团队合作,在自然界分布最广泛的I型CRISPR-Cas基因簇内部再次取得重大发现,首次揭示出一类从未报道过的对所偶联的CRISPR-Cas系统具护卫功能的双RNA毒素-抗毒素(CreTA)系统,解析了其RNA毒素的分子机制及基于CRISPR-Cas系统的RNA抗毒素的调控机制。
该项研究发现不仅为理解CRISPR-Cas系统的稳定性维持和广泛性分布提供了全新视角,同时还揭示出一大类在不同微生物中前所未知且功能多样的非编码小RNA的存在。这类前所未知且功能多样的非编码小RNA,曾被科学家们形象称为基因组中的“暗物质”。

creTA在CRISPR-cas基因簇中的位置及功能分析。中科院微生物所 供图
向华/李明团队表示,后续对这些丰富多样的微生物基因组“暗物质”的深入发掘,将进一步推动生物技术发展,包括对基因组编辑工具的完善、抗肿瘤小RNA的药物设计、新型抗生素的研发等都或将具有重要启发意义。
据了解,CRISPR-Cas是一种广泛存在于微生物中的适应性免疫系统。作为国际科学前沿,全球学界对该系统的研究,已促成迄今最高效的CRISPR-Cas9基因组编辑技术和基因检测技术得到应用,其中,CRISPR-Cas9基因组编辑技术获得2020年诺贝尔化学奖。(完)
 简体中文
简体中文