【亞太日報訊】據參考消息網報道,外媒稱,在美國等地未能進入市場的藥物在中國獲得新生。
據美國《華爾街日報》網站3月29日報道,2013年,百時美施貴寶公司停止了一款抗肝癌藥物的全球試驗,原因是它的藥效不及對手。公司轉而把這種名為“布立尼布”(Brivanib)的抗癌藥的許可權授予中國的一家初創企業。
總部設在上海的再鼎醫藥有限公司認為布立尼布在中國有很大的發展潛力,因為其對手——拜耳股份公司和Onyx制約公司開發的索拉非尼(商品名蕾莎瓦)——的治療費用約為每月7500美元,且不在國家保險範圍內。
再鼎公司的創始人杜瑩說:“我們希望給中國患者一個更加合理的價格。”
除了再鼎之外,中國還有好幾家企業與西方制藥公司在中國就尚未開發完成的藥物進行合作。在中國市場,頂尖的國際新藥需等候很長時間,而監管部門對中國藥物的審批過程較快。
報道稱,但這個新趨勢也帶來一個問題:中國是否成了劣質藥的傾卸場?
哈佛大學法學院教授格倫·科恩對醫德問題頗有研究,他說,由於各地監管標准不同,企業的一款藥在一個轄區獲得批准而在另一個轄區未獲批准並不反常,也不違法。
首先,在中國無需證明一種藥物優於現有藥物——那在美國是一道難關,90%的候選藥物在臨床試驗階段夭折。
有業內專家稱,制藥公司早就開始在中國銷售未曾在其他國家測試和投放市場的藥物。“為什麼?帶有諷刺挖苦意味的回答是:因為他們能行,”伯恩斯坦研究公司的亞太醫療保健分析師勞拉·納爾遜·卡尼說。
例如,中風治療藥物桂呱齊特(cinepazide)在上世紀80年代末和90年代退出西班牙、意大利和法國,原因是有報道說服用該藥會引起血液疾病。但根據瑞士信貸證券研究機構的數據,到2010年,它已成為中國的暢銷藥物。
負責營銷該藥的四環醫藥控股集團有限公司稱,它生產的桂呱齊特非專利藥的純度高於曾在歐洲出售的桂呱齊特品牌藥,其安全性和有效性得到了中國相關部門和患者的認可。
中國國家國家食品藥品監督管理局沒有答復記者有關其藥品審批流程和國內藥品質量的多次置評請求。美國食品和藥物管理局(FDA)不予評論其他國家的藥物試驗。
報道稱,中國長期以來一直在整頓藥物審批過程。2007年,國家藥監局前局長鄭筱萸被查處,他涉嫌收取制藥企業為使藥物獲批而提供的賄賂。
鄭筱萸擔任國家藥監局局長期間,逾15萬種藥品申請獲得批准。
報道稱,如今問題依然存在。國家藥監局稱,自去年它宣布將嚴懲提交虛假臨床試驗數據的公司以來,制藥公司撤回了近五分之四的藥品報批申請。
最近圍繞問題疫苗的醜聞再度引發了人們對藥品安全性的擔憂。
通過與中國本地企業建立合作關系,全球制藥公司有了第二次機會利用在其他地方未獲批准的藥品賺錢。中國政府希望建立一個競爭性的國內藥品市場,因而歡迎這類合作關系。
報道稱,對中國消費者來說,這個趨勢可能意味著新藥等待時間縮短、成本降低——即便這些藥品並不是同類產品中最好的。
目前,中國監管部門要求對獲得美國FDA批准的藥品進行額外試驗。臨床試驗審批過程可能會需要一年多時間。相比之下,美國監管部門表示,臨床試驗在提交申請的30天後即可開始。
艾美仕醫藥保健咨詢公司的數據顯示,截至2013年,2008年至2012年全球推出的藥品中只有21%在中國有售,而在美國這個比例是68%。
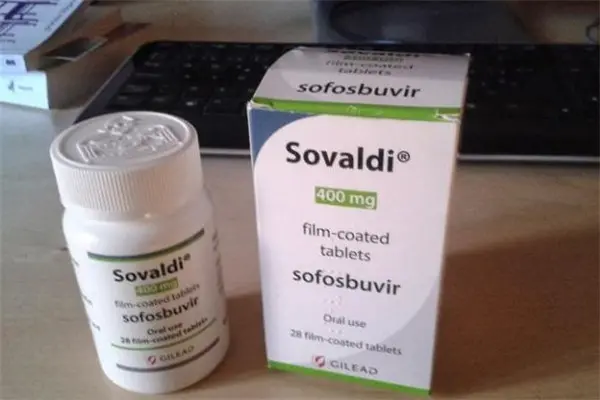
例如,革命性的丙肝新藥可在短短幾個月內治愈90%以上的患者,但一直沒有進入中國市場,而中國的丙肝發病率屬全球最高之列。中國患者仍依靠舊的療法,往往伴有惡心和脫發等副作用。
沈陽市現年46歲的孫薇(音)表示,她曾經注射了一年的干擾素,但丙肝仍未痊愈,她的體重急劇下降,還出現了嚴重的關節疼痛。她說:“我那時候看起來像60多歲的人。”
去年10月份,她前往新德裡購買了三個月量的吉利德科技公司所產暢銷藥Sovaldi,該藥在中國至今仍處於試驗階段。她表示,現在她的丙肝化驗結果已為陰性。
報道稱,中國的藥品監管部門已承諾加快艾滋病、癌症和傳染疾病新藥的審批速度,包括由外國制藥商生產的藥物。
百時美施貴寶正在中國報批其丙肝藥物asunaprevir,而在美國,考慮到競爭對手公司的藥品已接近獲批,該公司在FDA即將做出決定時取消了申請。日本、韓國和台灣地區以及拉丁美洲和東歐一些國家的監管機構已經批准asunaprevir與另外一種藥物聯合出售。
百時美施貴寶的發言人表示,該公司的丙肝治療方案著眼於各地市場獨有的醫療需求。
至於布立尼布,百時美施貴寶稱,該藥在中國可能會特別有前途,因為中國的肝炎高發,肝細胞癌比在西方要常見得多。
加利福尼亞大學洛杉磯分校的醫療政策與管理學教授斯圖爾特·施魏策爾說,買得起的藥物會比過於昂貴的特效藥更受人歡迎。
他說:“假設這些藥有效,但藥效不如市面上已有的藥,這些藥能說是‘不管用’嗎?”
 简体中文
简体中文