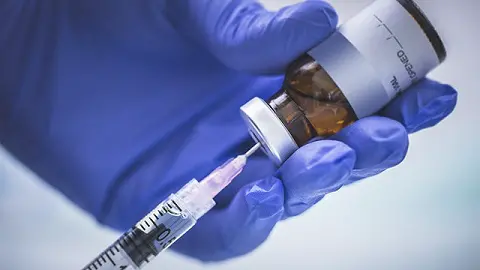
美国食品和药物管理局(FDA)负责疫苗事务的办公室负责人称,未来寻求Covid-19疫苗紧急使用授权的制药商,必须要满足比常规紧急授权更高的药效标准。
医学界对新冠疫苗是在紧急使用授权(EUA)而非按照FDA常规审批程序进入市场,提出了担忧,尤其是考虑到特朗普一直督促要在11月3日的大选前提供疫苗。
以往,紧急使用授权(EUA)要求公司证明其产品是 可能有效的 。FDA生物制品办公室主任彼得·马克斯(Peter Marks)周四表示,现在在授予紧急授权之前,FDA会要求更可靠的数据来说明冠状病毒疫苗的功效——即强化版的紧急使用授权(EUA plus)。
包括马克斯在内的FDA官员周四发表了一篇评论文章,试图向怀疑论者 保证他们正在遵循科学而不是政治 。
马克斯说,紧急使用授权的数据要求将更接近于常规申请的审批标准。他说,紧急授权通道将主要用于帮助摆脱一些文书工作和技术要求(程序),以便让美国人更快地获得疫苗。
在一项研究会议上,马克斯称,有效性和安全性的数据要求,“(可以)向我们表明,我们的产品可以达到预期效果。”他称,一旦疫苗进入市场,还会有额外的安全监控。
周四早些时候,在华盛顿经济俱乐部(Economic Club of Washington)的一次活动上,FDA局长哈恩(Stephen Hahn)在被问及注射疫苗何时可能获得批准时表示,FDA尚未收到任何正在进行临床试验的疫苗的数据。
“我没有水晶球,”哈恩称,“对我来说,这样的猜测真的不合适。我们还没有看到临床数据。我不可能知道我们什么时候会得到这些。”
FDA前局长斯科特·戈特利布(Scott Gottlieb)上周末表示,到2020年底,冠状病毒疫苗都不太可能在美国上市。
“我认为我们将在2020年拥有一种广泛使用的疫苗的可能性非常低,我认为我们需要将其视为2021年的重大事件。”Gottlieb称, “而且,如果我们确实在2020年有疫苗可用,它可能会以更具针对性的方式使用。”
 简体中文
简体中文